香港城大发现促进癌细胞转移的蛋白质 有望为癌症治疗提供新靶点
癌症扩散(metastasis)是癌症致命的主要原因。香港城市大学(香港城大)的研究团队最近发现一种蛋白质,可触发肝癌细胞和胰脏癌细胞转移和扩散,并与癌症患者的存活时间有相关性。这次研究经过一系列体内外模型验证,并与临床数据吻合,有望为癌症治疗带来新靶点。
负责领导这项跨院校合作研究的香港城大副校长(研究及科技)兼杨建文讲座教授(生物医学)杨梦甦教授说:“癌症转移是一个复杂的过程。目前经已有研究指出,随着肿瘤增长,肿瘤和周边组织的硬度会增加,造成一些可让细胞通过的‘受限空间’(confined spaces)及细孔管道,令肿瘤细胞得以转移和扩散。可是这种癌细胞‘受限转移’(confined migration)的原理,至今仍然未明。”他续说:“这次研究就是为了深入理解癌细胞转移的机理,同时找出与之相关的基因和蛋白。”
肝癌是全球第二大的致命癌症,而肝细胞癌(hepatocellular carcinoma)则属常见的肝癌类型;与此同时,胰脏导管腺癌(pancreatic ductal adenocarcinoma)的五年存活率亦低于一成。上述两者都属于“实体肿瘤”(solid tumour),特质是沉积了过溢的“细胞外基质”(extracellular matrix,ECM),当中带有可容许癌细胞转移的受限细孔(confined pores)或管道。因此,团队选择以上述两种癌症类型作为研究对象。
开发可研究癌细胞转移原理的方法
透过与重庆医科大学附属第二医院合作,杨教授的团队收集了153名肝细胞癌和63名胰脏导管腺癌患者的样本,而这些患者在手术前均无接受化疗或放射治疗。另外,团队又于美国国立卫生研究院获得了人体肝癌及胰脏癌的癌细胞株以作研究。
杨教授说:“研究最主要的挑战是模拟复杂的癌细胞微环境,而目前缺乏有关受限转移的研究模型。因此,我们设计了一系列多维度的平台和2D及3D体内外模型,以便全面研究癌细胞转移的过程。”
这包括单细胞迁移及集体细胞(collective cell)转移的微流控晶片(microfluidic chips)模型,以及不同硬度水凝胶混合物制成的三维癌细胞侵袭模型(3D invasion assay),以模拟肿瘤的体内环境。团队并利用高通量基因测序(Next-generation sequencing,NGS)技术和液相层析质谱技术(liquid chromatography-mass spectrometer,LC-MS),以确认来自癌细胞组织所表达的基因和释出的蛋白质。

团队设计和制造的微流控晶片,以模拟体内环境。(图片来源:香港城市大学)
LH1是促进肝细胞癌和胰脏导管腺癌细胞受限转移的主因
团队通过NGS和LC-MS的转录组学和蛋白质组学分析,确认肝细胞癌内异常释出的一种名为“赖氨酸羟化酶1”(lysyl hydroxylase 1,LH1)的蛋白质。而团队制作的微流控晶片和三维侵袭模型,亦证明了LH1能够提高肝细胞癌和胰脏导管腺癌细胞的受限转移速度,以及增强入侵邻近组织的能力;相反在抑制LH1基因表达的情况下,相关能力亦会随之被减低。
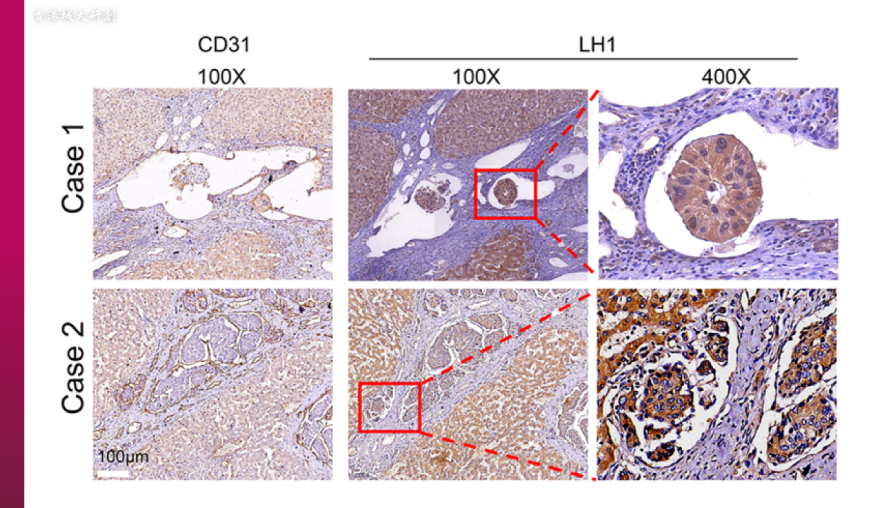
肝细胞癌的肿瘤栓子(tumour embolus)释出大量LH1蛋白。(图片来源:© Yang, Z. et al. https://molecular-cancer.biomedcentral.com/articles/10.1186/s12943-023-01727-9)
研究又证实LH1可与一种名为Septin2(SEPT2)的蛋白质结合,同时提高其稳定性。细胞转移需要较高的机动能力,SEPT2蛋白于当中起着重要作用,并能促进肌动蛋白网络(actin-network)之形成;而肌动蛋白网络正是细胞迁移的动力核心,因此促进肌动蛋白网络的形成,能推动肝细胞癌和胰脏导管腺癌细胞的受限转移与扩散。
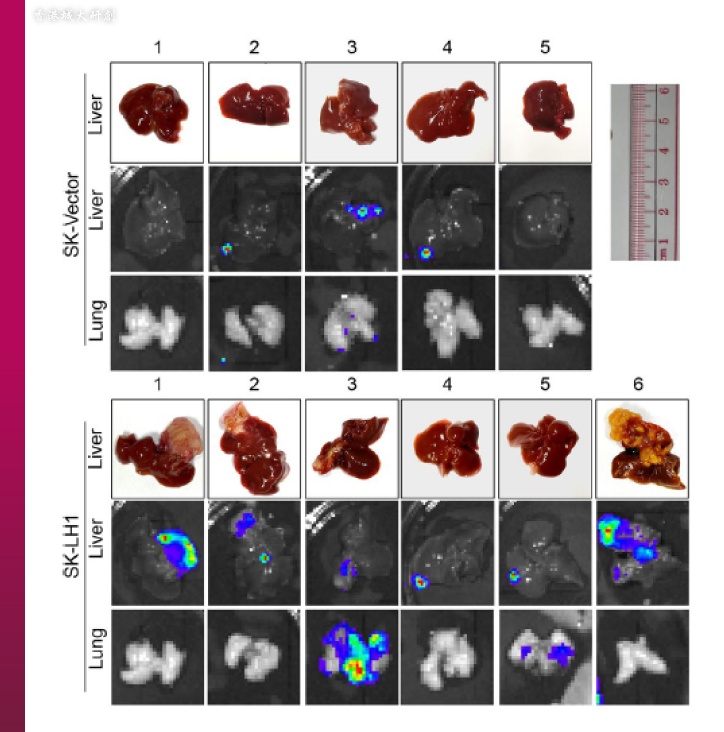
研究团队发现含过量LH1的小鼠肝脏原位注射(liver orthotopic injection)模型,肝脏肿瘤的体积明显较大。(图片来源:© Yang, Z. et al. https://molecular-cancer.biomedcentral.com/articles/10.1186/s12943-023-01727-9)
癌细胞较高LH1含量的患者预后情况欠佳
研究团队进一步分析LH1与肝细胞癌、胰脏导管腺癌症患者“预后”(意即预测诊治结果或复发机会)的关连性。临床样本显示,癌细胞LH1含量较高的患者预后情况欠佳,存活率只得LH1含量较低的患者的一半。
另外,癌细胞LH1含量较高的肝细胞癌及胰脏导管腺癌症患者,存活期(由诊断至死亡)较短,分别只有39及17个月,而LH1含量较低的患者的存活期则为86及22个月。同时,他们的“无病存活期间”(意即由初次治疗至复发)分别只有11.5及14个月,而LH1含量较低的患者则分别为41及19个月。

上图显示LH1蛋白水平含量较高的肝细胞癌(图A及B)及胰脏导管腺癌症患者(图C及D),整体存活期及无病存活期间都相对较短。(图片来源:© Yang, Z. et al. https://molecular-cancer.biomedcentral.com/articles/10.1186/s12943-023-01727-9)
杨教授解释说:“我们设计的平台及方法可为癌症受限转移提供独特的研究模式。团队证实了LH1可通过稳定SEPT2以促进癌细胞的受限迁移和扩散,而高含量的LH1亦会令肝细胞癌、胰脏导管腺癌症患者的预后情况更差。研究结果有望找出新靶点,以便研发新的癌症诊断技术及药物治疗。”
上述研究成果已于国际顶级癌症相关研究科学期刊《Molecular Cancer》上发表,题为〈Lysyl hydroxylase LH1 promotes confined migration and metastasis of cancer cells by stabilizing Septin2 to enhance actin network〉。
研究的第一作者为杨教授研究团队的博士研究生杨紫邯小姐。共同通讯作者为杨教授,以及曾任杨教授团队访问学者、现任重庆医科大学附属第二医院副教授周智航博士。该跨院校合作研究小组还包括香港城大生物医学系及董氏生物医学中心、重庆医科大学附属第二医院医消化内科和病理科、香港城大福田研究院精准诊疗技术研究部,以及香港理工大学的科研人员。研究得到香港研究资助局、国家自然科学基金及深港科技创新合作区的资助。

香港城大副校长(研究及科技)兼杨建文讲座教授(生物医学)杨梦甦教授(右三),与其研究团队的博士研究生杨紫邯小姐(右四)及其他成员。(图片来源:香港城市大学)
当前页面地址:http://www.jtjkw.org/news/11187.html
-
无相关信息
今日推荐
爱康国宾深耕健康管理,致
- 爱康国宾深耕健康管理,致力提升民众生命质量
- 悦康药业引领创新发展 羟基红花黄色素A等明星产
- 注射用羟基红花黄色素A新药上市申请获受理 悦康
- 天然植萃助力润肠通便,消化科专家、营养师推荐NU-L
- 南昌首大医院收费正规透明合理,让患者朋友安心
- 南昌首大医院看男科怎么样?专病专治 正规诊疗
- 南昌男科医院哪家好?南昌首大医院注重隐私,优质服务
- 南昌首大医院怎么样?让病患者感受到家庭般的舒适!
- 南昌首大医院靠谱吗?先进设备,精准治疗
- 南昌首大医院好不好?诚信医院,细节见真心
- 南昌首大医院怎么样?设备正规、诚信医疗
- 甜蜜来袭,糖友做好这几点,圣诞节也可以狂欢!
- 冷空气来袭!牙齿疼得“发抖”怎么办?牙痛停滴丸来帮
- 同名不同效!白云山小柴胡三大优势守护冬季健康
- 南昌首大医院励精图治,服务大众健康!